Química para Estudiantes de Nutrición - Unidad 9: Gases
Gases y Sustances que Existen Como Gases
- Los gases no tienen forma ni volumen propio se expanden hasta llenar y adoptar las formas de los recipientes que los contienen.
- Los gases no tienen forma ni volumen propio se expanden hasta llenar y adoptar las formas de los recipientes que los contienen.
- Los gases se difunden unos en otros y se mezclan en todas las proporciones.
- No podemos ver las partículas individuales de un gas, aunque podemos apreciar si la masa de gas tiene color como por ejemplo el Cl2(g) es un gas amarillo verdoso, el Br2(g) es un gas gas rojo pardusco, y el I2(g) es un gas violeta.
- La mayor parte de los gases comunes como H2, O2, N2, CO y CO2, son incoloros.
- Tienen baja densidad en comparación a sólidos y líquidos
Gases nobles
Leyes de los Gases
Parámetros de las leyes de los gases
- Presión: es la cantidad de fuerza aplicada sobre una superficie. La unidad de presión en SI es el pascal (Pa) pero para el análisis matemático de las leyes de los gases se usa la unidad de atmósfera (atm); 1 atm es igual a 101325 Pa.
- Volumen: es el espacio ocupado por una cierta cantidad de masa y se expresa en litros (L).
- Temperatura: es la medida de la agitación interna de las partículas de gas y se expresa en unidades kelvin (K). Para transformar centígrados a kelvin, sólo tenemos que sumar 273.
- Moles: es la cantidad de masa del gas. Se representa con la letra n y sus unidades son moles.
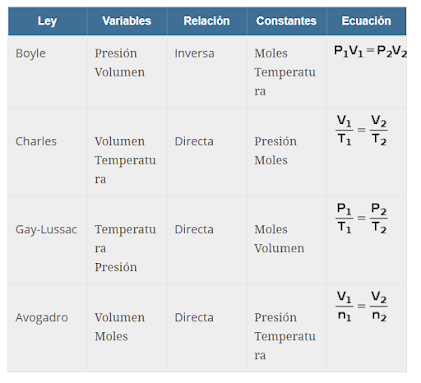
Ley de Boyle
La presión absoluta y el volumen de una masa dada de un gas confinado son inversamente proporcional, mientras la temperatura no varíe dentro de un sistema cerrado.
Robert Boyle (1627-1691) dedujo esta ley en 1662. La presión y el volumen de un gas ideal están inversamente relacionados: cuando uno sube el otro baja y viceversa.
La ley de Boyle se expresa matemáticamente como:
o
En esta ley solo existen dos variables: presión y volumen. Se asume que la temperatura del gas y el número de moléculas del gas en la jeringa no cambia.
Ejemplo
Si el gas en una jeringa está originalmente a 1 atm y el volumen es 5 mL, luego presión por volumen (PV) será igual 5 atm-mL. Si el émbolo se empuja hasta reducir el volumen de 2,5 mL, entonces la presión tendrá que aumentar hasta 2 atm, de manera de mantener constante PV.
Ley de Charles
A presión constante, el volumen de una dada cantidad de un gas ideal aumenta al aumentar la temperatura.
Jacques Alexandre Charles (1746-1823) hizo el primer vuelo en globo inflado con hidrógeno en 1783 y formuló la ley que lleva su nombre en 1787.
La ley de Charles se expresa matemáticamente como:
ó
Cuando se aplica la ley de Charles, se debe usar la temperatura absoluta. Para convertir la temperatura de ºC a kelvin (K) se suma 273. Ejemplo:
20 ºC + 273= 293 K
100 ºC + 273= 373 K
Ejemplo
Una llanta de un vehículo se llena con 100 L (V1) de aire a 10ºC. Luego de rodar varios kilómetros la temperatura sube a 40ºC (T2) ¿Cuánto será el volumen de aire (V2) en la llanta?
Ley de Gay-Lussac
La presión es directamente proporcional a la temperatura.
Joseph Louis Gay-Lussac (1778-1850)
La ley de Gay-Lussac se puede expresar matemáticamente como:
ó
Al aumentar la temperatura de un gas confinado en un recipiente, aumenta la energía cinética de las moléculas del gas y, como consecuencia, las colisiones con las paredes del contenedor. El aumento de la frecuencia de colisiones resulta en el aumento de la presión.
En utensilios como las ollas de presión y las teteras existen válvulas de seguridad que permiten la liberación de forma segura la presión antes de que alcance niveles peligrosos.
Ejemplo
Si la presión y la temperatura del aire en una jeringa están originalmente a 1,0 atm y 293 K y se coloca la jeringa en agua hirviendo, la presión aumentará a 1,27 atm, según los siguientes cálculos:
Ley de Avogadro
El volumen es directamente proporcional de los moles de gas.
La cantidad de gas se mide en moles (el símbolo estándar para moles es n). El volumen de un gas es directamente proporcional al número de moléculas presente, es decir, el número de moles de gas.
La ley de Avogadro se expresa matemáticamente como:
ó
Ejemplo
Un ejemplo simple de la ley de Avogadro es cuando inflamos un globo. A medida que el globo se va inflando entra más moléculas de dióxido de carbono y el volumen va aumentando. La temperatura y la presión se mantienen constantes.
Fuente: toda la materia.com
Ecuación del Gas Ideal
La ley o ecuación de gases ideales conjuga las leyes de Boyle, Charles, Gay-Lussac y Avogadro, relacionando las cuatro cantidades: presión, volumen, temperatura y moles.
La ley de los gases ideales se expresa matemáticamente como:
ó
En esta ecuación, R representa la constante de la ley de los gases ideales. También se puede expresar como:
R tiene un valor de:
Ejemplo
En una caja de 20 L se encuentra un gas a 300K y 101 kPa de presión ¿Cuántos moles de gas se encuentran en la caja?
Estequiometría de los gases
Ley de Dalton de las presiones parciales
La presión total de una mezcla de gases es igual a la suma de las presiones de cada gas individualmente.
Las presiones parciales fue un concepto presentado por el químico inglés John Dalton (1766-1844). La ley de Dalton se expresa matemáticamente como::
Ejemplo
En un contenedor de 2 L se encuentra 0,40 atm de oxígeno gaseoso y 0,60 atm de gas nitrógeno. La presión total del contenedor será:
La presión dentro del contenedor será igual a 1 atm.


Comentarios