Química para Estudiantes de Nutrición: Unidad 3: Elementos
La Tabla Periódica y La Clasificación de los Elementos
La tabla periódica es la forma de ordenar los elementos químicos según sus propiedades físicas. La tabla periódica que conocemos hoy en día fue creado por Dmitri Mendeléiv en 1869.
Actualmente la tabla periódica se compone de 118 elementos que se distribuyen en 7 filas períodos horizonatales y 18 columnas verticales, que se conocen como grupos.
Propiedades de los Elementos de la Tabla Periódica: Metales, no metales, y metaloides
Fuente: elaboración propia
Propiedades de metales:
- La mayoría de los metales son maleables (pueden formar láminas delgadas, por ejemplo un centímetro cúbico de oro puede aplastarse hasta formar una placa que podría cubrir un campo de fútbol completo), y son dúctiles (pueden estirarse para formar hilos muy delgados o alambres).
- Son sólidos a temperatura ambiente (excepto el Hg, que es líquido)
- Tienden a tener energías de ionización bajas y típicamente pierden electrones es decir se oxidan en sus reacciones químicas
Propiedades no-metales:
- Su apariencia varía mucho
- En general no presentan lustre
- No son buenos conductores de la electricidad ni del calor excepto por ciertas excepciones
- En general, los puntos de fusión son menores que los de los metales
Propiedades de los Elementos de la Tabla Periódica: Tipos de metales y no metales
Fuente: Elaboración propia
- Los metales alcalinos siempre pierden un electrón y presentan iones con carga 1+
- Los metales alcalino-térreos siempre pierden dos electrones y presentan iones con carga 2+
- Los metales de transición no tienen un patrón común y sus iones pueden tener cargas 2+, 1+ y 3+, pero pueden encontrarse otros cationes
- Los compuestos entre un metal y un no-metal tienden a ser iónicos
- La mayoría de los óxidos metálicos son basicos y al disolverse en agua reaccionan para formar hidróxidos metálicos
Propiedades químicas de los elementos
Tamaño o Radio Atómico
- Mitad de la distancia entre los núcleos de dos átomos iguales.
- En un mismo periodo disminuye hacia la derecha (al aumentar la carga efectiva).
- GRUPO: Aumenta de abajo hacia arriba.
- A menor tamaño del átomo, mayor será la fuerza de atracción sobre el electrón. Esto es debido a que los electrones de la última capa estarán más fuertemente atraídos.
Fuente: CienciasFera
Fuente: 100química
Fuente: USON
Efecto de iones en Radio Atómico (Radio iónico)
- Es el radio que ?ene un átomo que ha perdido o ganado electrones, adquiriendo una estructura del gas noble más cercano.
- CATIONES: Son menores que los átomos neutros por la mayor carga nuclear efec?va (menor efecto de apantallamiento o de repulsión de electrones)
- ANIONES: Son mayores que los átomos neutros por la disminución de la Zeff (mayor apantallamiento o repulsión electrónica)
Potencial de Ionización/ Energía de Ionización
Energía necesaria que se debe administrar a un elemento para
quitar un electrón más externo (queda convertido en catión).
Cada elemento polielectrónico tiene tantos POTENCIALES DE
IONIZACIÓN como electrones tenga. Siendo el primero menor que el
resto (es más dificil extraer electrones más cercanos al núcleo).
- Proceso Endotérmico (positivo)
- Disminuye hacia abajo en un mismo grupo
- Aumenta hacia la derecha en un mismo período
Fuente: Tipos de Energía
Afinidad Electrónica
Es la forma como se mide la energía liberada o absorbida cuando un átomo recibe un electrón en su capa de valencia, es decir, cuando se vuelven aniones.
Fuente: USO
AE (positivas) o endotérmico. Es necesario un aporte de energía extra para poder
convertirlos en aniones. METALES (Poca tendencia a captar electrones)
AE (negativas) o exotérmico. Se libera mucha energía cuando un electrón se une al
átomo. El proceso de captar un electrón los estabiliza. AE negativa. NO METALES
(Fácilmente captar electrones).
TABLA REIODICA CON VALENCIAS
Electronegatividad
Propiedad química que mide la capacidad de un átomo para atraer hacia él los
electrones, o densidad electrónica, cuando esta combinado con otros elementos.
No Metales = electronegatividades altas.
Metales= electronegatividades bajas o electropositivos.
Escala de Pauling (Basada en valores de energías de enlace de diferentes moléculas presentes en el átomo en
cuestión).
Valores de 0.7 a 4.
Conociendo las energías de los enlaces A-A y B-B, se puede calcular el parámetro D como sigue:
Δ = EAB – ½ (EAA + EBB)
Escala de Mulliken. Promedio del potencial de ionización de los electrones de valencia y la afinidad electrónica.
Electrones de Valencia
Electrones de Valencia: Son los electrones que se encuentran en la última capa electrónica (denominada orbitales de valencia) y tienen muchas posibilidades de participar en una reacción química.
Estos electrones poseen el número cuántico principal n más alto. Tienen vital importancia en la formación de moléculas y compuestos ya que determinan la capacidad del átomo para formar enlaces. Cuando un elemento se une a otro lo hace a través de sus electrones de valencia.
También se puede decir que estos electrones son los electrones más alejados al núcleo del átomo, y en consecuencia los que pueden participar comúnmente en la formación de enlaces químicos.
Capa de Valencia
Es el lugar donde se encuentran ubicados los electrones de valencia, corresponde al último nivel del átomo. O más bien lo que sería el orbital más lejano. En esta imagen se puede apreciar claramente cuales son los electrones de valencia.
Fuente: Edured
Fuente: Ecured
Tipos de Enlace Químico
Fuente: CNICE
Covalente
Los enlaces covalentes son las fuerzas que mantienen unidos entre sí los átomos no metálicos (los elementos situados a la derecha en la tabla periódica -C, O, F, Cl, ...).
Estos átomos tienen muchos electrones en su nivel más externo (electrones de valencia) y tienen tendencia a ganar electrones más que a cederlos, para adquirir la estabilidad de la estructura electrónica de gas noble. Por tanto, los átomos no metálicos no pueden cederse electrones entre sí para formar iones de signo opuesto.
En este caso el enlace se forma al compartir un par de electrones entre los dos átomos, uno procedente de cada átomo. El par de electrones compartido es común a los dos átomos y los mantiene unidos, de manera que ambos adquieren la estructura electrónica de gas noble. Se forman así habitualmente moléculas: pequeños grupos de átomos unidos entre sí por enlaces covalente
Ionico
Este enlace se produce cuando átomos de elementos metálicos (especialmente los situados más a la izquierda en la tabla periódica -períodos 1, 2 y 3) se encuentran con átomos no metálicos (los elementos situados a la derecha en la tabla periódica -especialmente los períodos 16 y 17).
En este caso los átomos del metal ceden electrones a los átomos del no metal, transformándose en iones positivos y negativos, respectivamente. Al formarse iones de carga opuesta éstos se atraen por fuerzas eléctricas intensas, quedando fuertemente unidos y dando lugar a un compuesto iónico. Estas fuerzas eléctricas las llamamos enlaces iónicos.
Metalico
Para explicar las propiedades características de los metales (su alta conductividad eléctrica y térmica, ductilidad y maleabilidad, ...) se ha elaborado un modelo de enlace metálico conocido como modelo de la nube o del mar de electrones:
Los átomos de los metales tienen pocos electrones en su última capa, por lo general 1, 2 ó 3. Éstos átomos pierden fácilmente esos electrones (electrones de valencia) y se convierten en iones positivos, por ejemplo Na+, Cu2+, Mg2+.
Los iones positivos resultantes se ordenan en el espacio formando la red metálica. Los electrones de valencia desprendidos de los átomos forman una nube de electrones que puede desplazarse a través de toda la red.












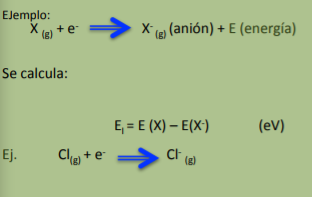




Comentarios