Quimica para Estudiantes de Nutrición: Unidad 5 - Reacciones Químicas
Reacción Quimica y Ecuación Química
En la naturaleza, la velocidad con la que se llevan a cabo las reacciones químicas es variable. Algunas transformaciones son muy lentas, como la oxidación de los metales; otras muy rápidas, como la explosión de nitroglicerina.
¿Cómo se efectúa una reacción química?
Al combinarse las sustancias ocurre un rompimiento de los enlaces que mantienen unidos a los átomos que las conforman, de tal manera que estos átomos se reorganizan mediante nuevos enlaces entre ellos, lo que da lugar a nuevas sustancias.
Representación de una reacción química
Describe los cambios que suceden en la naturaleza debido al reordenamiento de los átomos de la materia de forma objetiva, cuantitativa y ordenada.
Ecuaciones químicas
Una ecuación química es la representación escrita, abreviada y simbólica de una reacción química; nos proporciona un medio para mostrar un cambio químico, los reactivos y los productos, su composición atómica y la relación molecular donde interviene.
La ecuación puede ser expresada por medio de símbolos y fórmulas de las sustancias participantes, por ejemplo:
Convencionalmente, a las sustancias que se escriben a la izquierda de la flecha se les llama reactivos o reactantes y constituyen el primer miembro de la ecuación.
Las sustancias escritas a la derecha de la flecha forman el segundo miembro de la ecuación y constituyen el producto de la reacción.
Ejemplo:
La siguiente tabla que se refiere a los símbolos auxiliares utilizados en una reacción química.
Fuente: IPN
Tipos Básicos de Reacciones
Oscar Castillero de Psicología y Mente resume los 11 tipos básicos de reacciones químicas.
1. Reacciones de síntesis o adición
En este tipo de reacciones químicas se combinan dos o más sustancias para formar un único compuesto. La combinación de metal y oxígeno para formar óxidos es un ejemplo, dado que da pie a moléculas relativamente estables que en algunos casos pueden ser utilizadas para fabricar materiales frecuentes en nuestra vida cotidiana.
2. Reacciones de descomposición
Las reacciones de descomposición son aquellas en las que un compuesto concreto se descompone y divide en dos o más sustancias. Es lo que ocurre por ejemplo cuando se produce la electrólisis del agua, separándose el agua en hidrógeno y oxígeno.
3. Reacciones de desplazamiento, sustitución o intercambio
Uno de los tipos de reacción química en que un elemento de un compuesto pasa a otro debido a su interacción. En este caso el elemento traspasado se ve atraído por el otro componente, que debe tener mayor fuerza que el compuesto inicial.
Fuente: Dreamstime
4. Reacciones iónicas
Se trata de un tipo de reacción química que se produce ante la exposición de compuestos iónicos a un disolvente. El compuesto soluble se disuelve, disociándose en iones.
5. Reacciones de doble sustitución
Se trata de una reacción semejante a la de la sustitución, con la excepción de que en en este caso uno de los elementos que forman uno de los compuestos pasa el otro a la vez que este segundo compuesto pasa al primero uno de sus propios componentes. Es necesario para que se produzca la reacción que al menos uno de los compuestos no se disuelva.
6. Reacciones de oxidorreducción o redox
Se denomina como tal a aquel tipo de reacción química en que existe intercambio de electrones. En las reacciones de oxidación uno de compuestos pierde electrones en favor del otro, oxidándose. El otro compuesto se reduciría al aumentar su número de electrones.
Este tipo de reacciones ocurren tanto en la naturaleza como de manera artificial. Por ejemplo, es el tipo de reacción que hace que necesitemos respirar (adquiriendo oxígeno del medio) o que las plantas realicen la fotosíntesis.
7. Reacciones de combustión
Un tipo de oxidación extremadamente rápida y enérgica, en el que una sustancia orgánica reacciona con oxígeno. Esta reacción genera energía (generalmente calorífica y lumínica) y puede generar llamas y que suele tener como resultado un producto en forma de gas. Un ejemplo típico es la combustión de un hidrocarburo o del consumo de glucosa.
8. Reacciones de neutralización
Este tipo de reacción química se produce cuando una sustancia básica y otra ácida interaccionan de tal manera que se neutralizan formando un compuesto neutro y agua.
9. Reacciones nucleares
Se denomina como tal toda aquella reacción química en la que se provoca una modificación no de los electrones de los átomos, sino de su núcleo. Esta combinación o fragmentación va a provocar un elevado nivel de energía. Se denomina fusión a la combinación de átomos, mientras que su fragmentación recibe el nombre de fisión.
10. Reacciones exotérmicas
Se denomina reacción endotérmica a toda aquella reacción química que provoca la emisión de energía. Por lo general, estas emoisiones de energía se dan al menos en forma de calor, si bien en los casos en los que ocurren explosiones también aparece la energía cinética.
11. Reacciones endotérmicas
Las reacciones endotérmicas son todos aquellos tipos de reacción química en la que la interacción entre elementos absorbe energía del medio, siendo el producto final mucho más enérgico que los reactivos.
Ionización
La ionización es el proceso químico o físico mediante el cual se producen iones, estos son átomos o moléculas cargadas eléctricamente debido al exceso o falta de electrones respecto a un átomo o molécula neutra. A la especie química con más electrones que el átomo o molécula neutra se le llama anión, y posee una carga neta negativa, y a la que tiene menos electrones catión, teniendo una carga neta positiva. Hay varias maneras por las que se pueden formar iones de átomos o moléculas.
Fuente: 100ciaquimica.net
Electrolitos y No Electrolitos
Un electrólito es una sustancia que se descompone en iones (partículas cargadas de electricidad) cuando se disuelve en los líquidos del cuerpo o el agua, permitiendo que la energía eléctrica pase a través de ellos. Algunos de los ejemplos de electrolitos son el sodio, el potasio, el cloruro y el calcio. La responsabilidad principal de los electrolitos en los seres vivos es llevar nutrientes hacia las células y sacar los desechos fuera de estas.
Los electrólitos pueden ser débiles o fuertes, según estén parcial o totalmente ionizados o disociados en medio acuoso. Un electrolito fuerte es toda sustancia que al disolverse en agua lo hace completamente y provoca exclusivamente la formación de iones con una reacción de disolución prácticamente irreversible. Un electrolito débil es una sustancia que al disolverse en agua lo hace parcialmente y produce iones parcialmente, con reacciones de tipo reversible.
Los electrolitos generalmente existen como ácidos, bases o sales.
Un electrólito se describe como concentrado si tiene una alta concentración de iones; o diluido, si tiene una baja concentración. Si una alta proporción del soluto disuelto se disocia en iones, la solución es fuerte; si la mayor parte del soluto permanece no ionizado la solución es débil.
Fuente: Libretexts
Los electrólitos juegan un papel importante en los seres vivos. Ayudan a mantener el fluido adecuado y el balance ácido-base dentro del cuerpo.
Algunos de los cationes biológicos más importantes son Na+, K+, Ca^2+ y Mg. Además del Cl-, el O^2- y el S^2-, los aniones más importantes son los aniones poliatómicos. Un ión poliatómico es un ión que contiene más de un átomo. Ejemplos de iones poliatómicos son, el ión bicarbonato (HCO3-), que es un anión compuesto de cinco átomos, al igual que el ion sulfato (SO4^2-); el catión amonio (NH4+) compuesto por cinco átomos, etc.
Balancea de Ecuación Químicas
Aqui se encuentra una herramienta útil para el balanceo de ecuaciones químicas.
El balanceo de ecuaciones no es mas que una consecuencia de la ley
de conservación de la masa de Lavoisier, por lo que la masa de los reactivos
debe ser igual a la masa de los productos, esto implica que la cantidad y
variedad de átomos presentes en los reactivos debe mantenerse en los
productos, (lo único que varía es la forma en que están combinados).
Para balancear una ecuación química primero tenemos que identificar el
tipo a la que ésta pertenece. Las reacciones químicas pueden clasificarse en
términos generales como ácido-base u óxido-reducción:
- En las reacciones ácido-base ninguna especie cambia su estado de oxidación.
- En las reacciones del tipo óxido-reducción, al menos dos especies cambian de estado de oxidación:
- Cuando una especie pierde electrones su número de oxidación aumenta (se hace más positiva o menos negativa Ej.: Fe2+ → Fe3+ , S 2- → S 0 ). A este proceso se le conoce como oxidación.
- Cuando una especie gana electrones su número de oxidación disminuye (se hace menos positiva o más negativa, Ej.: Mn4+ → Mn2+ , O -1 → O -2 ). A este proceso se le conoce como reducción.
A la especie que se reduce, (la que gana electrones), se le denomina el
agente oxidante, esto se debe que los electrones que esta especie gana, lo
hace a expensas de otra especie, es decir le “arrebata” los electrones a otra
especie química, esto es: la oxida. De forma análoga, a la especie que se
oxida (la que pierde electrones), se le denomina como el agente reductor
pues al perder electrones lo hace a expensas de otra especie química a la cual
cede sus electrones, causando entonces la reducción de esta otra. Por
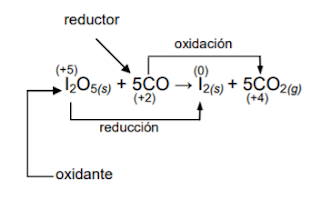
ejemplo:
Nota que el yodo al reducirse oxida al CO, por lo que el I2O5 es el agente
oxidante. De igual forma el CO es el agente reductor, pues al oxidarse reduce
al I2O5.
Balanceo:
Balancear significa encontrar los coeficientes estequiométricos en una
reacción tal que la cantidad de átomos presentes en los reactivos sea igual a
aquellos presentes en los productos:
Fe2O3 + C → Fe + CO se balancea como: Fe2O3 + 3C → 2Fe + 3CO
Fuente: FQUIM
Si la cantidad de átomos presentes antes y después de la reacción son los
mismos, entonces la suma de la masa de los reactivos es necesariamente igual
a la suma de la masa de los productos, (esto es: se cumple la ley de
conservación de la masa).
El balanceo es un procedimiento sencillo, en el caso de reacciones de óxidoreducción (que de aquí en adelante llamaremos red-ox), hay que balancear
tanto masa como carga. Las reacciones ácido base solo debe balancearse la
masa por lo que son un caso mas simple que las red-ox. Así, si aprendes a
balancear reacciones red-ox podrás balancear reacciones ácido-base sin
dificultad.
Identifica el tipo de reacción de que se trata (ácido-base o redox), para ello
tienes que asignar los estados de oxidación de cada átomo en cada una de las
especies involucradas. En este ejemplo usaremos la siguiente reacción:
En este caso, el cromo gana electrones pues disminuye su estado de oxidación
(de +6 a +3), esto es, se reduce, mientras que el arsénico pierde electrones, es
decir, se oxida, pues aumenta su estado de oxidación (de +3 a +5), por lo que
la reacción anterior se clasifica como a una reacción redox.
A pesar de que las reacciones de oxidación y reducción ocurren de forma
simultánea, para fines del balanceo, separa la reacción redox en dos
semireacciones: una semi-reacción de oxidación y una semi-reacción de
reducción:










Comentarios